Клабуков И.Д., к.б.н. заведующий отделом передовых клеточных технологий Первого МГМУ им. И.М. Сеченова Минздрава России
Обзор подготовлен при финансовой поддержке Георгия Соловьёва (Reminder Media).
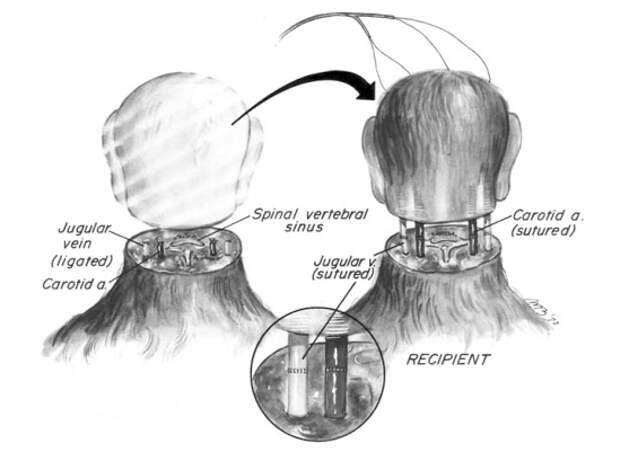
В настоящем обзоре рассматриваются научные и технические проблемы пересадки головы в ортотопическую позицию с пересечением спинномозгового канала и формированием анастомоза.
Введение
Пересадка головы на сегодняшний день остается одной из самых трудных задач в медицине. Голова — одна из самых крупных и сложных частей тела человека.
Для успешной пересадки головы необходимо последовательное решение следующих проблем:
1. Обеспечение должной анестезии во время трансплантации.
2. Отделение головы от туловища.
3. Сохранение изолированной от туловища головы в условиях, минимизирующих повреждение головного мозга. В момент отделения от туловища наблюдается резкое падение внутричерепного кровяного давления, прекращается обеспечение мозга кислородом, что приводит к повреждениям функций мозга.
4. Осуществление спинномозгового анастомоза — сшивание нервных волокон спинного мозга с нервными волокнами головы.
5. Осуществление микрохирургических анастомозов кровеносных сосудов.
6. Восстановление циркулярных дефектов трахеи и пищевода, осложнения которых обусловлены прежде всего продолжительной ишемией, а также нарушением нормальной периферической иннервации и кровоснабжения.
7. Проведение ортопедических операций по восстановлению целостности, механической прочности и обеспечению подвижности костных элементов.
8. Обеспечение иммунологической совместимости головы и тела.
Большинство известных примеров пересадки головы или голова-грудного комплекса относятся к сосудистой хирургии, а совсем не к нейрохирургии. Так, первая известная операция парабиоза относится к 1912 году [1], непосредственно после первых работ Алексиса Карреля по отработке сосудистого шва.
В 1950-х годах Владимиром Демиховым совместно с его помощником Владимиром Горяйновым была проведена серия экспериментов по сшиванию пересеченных пополам крыс и собак с получением подобий химерных организмов. Результаты данного эксперимента описаны в его книге [2]. У животных восстанавливалось кровоснабжение нижней части тела путем наложения анастомоза аорт и полых вен. При этом пересеченные фрагменты спинного мозга просто фиксировались, попыток их сшивания для получения полноценной химеры не предпринималось. Из недостатков можно также отметить отсутствие связей лимфатической системы, спинномозгового и периферических нервов. Однако подобная серия экспериментов на крысах по сборке химерных организмов представляется хорошей экспериментальной моделью для отработки различных методов наложения сосудистого шва и восстановления проводимости спинномозгового канала. При этом ожидаемая продолжительность жизни химерного организма может составить несколько суток.
Таким образом, практические задачи трансплантации головы сводятся к отработке методов обеспечения целостности изолированного головного мозга, микрохирургических анастомозов кровеносных сосудов, восстановлению, циркулярных дефектов трахеи и пищевода, ортопедических операций по восстановлению целостности, механической прочности и обеспечению подвижности костных элементов, обеспечению иммунологической совместимости.
Вместе с тем, ключевой научной задачей является создание условий для восстановления проводимости нервных волокон спинного мозга.
Проблемы стимулирования нейрогенеза в пересеченном периферическом нерве
Модель восстановления пересеченного волокна периферического нерва является хорошей моделью для понимания динамики регенеративных процессов, происходящих в нервной ткани. При восстановлении проводимости пересеченного нервного волокна наибольших результатов реконструктивная хирургия добилась в области травм пересеченных периферических нервов, при которой не всегда возможно использование аутотрансплантатов. В этом случае используются т.н. "нервные кондуиты" — биоинженерные имплантаты, стимулирующие репаративный нейрогенез.
Можно выделить несколько концептуальных подходов в развитии кондуитов:
1. Сосудистый кондуит
Со второй половины 20-го века и до настоящего времени в клинической практике используются венозные и артериальные сосуды для вставки в место повреждения. Основными недостатками данного подхода являются дополнительное повреждение в донорской зоне, перегибы и отсутствие каркасной функции у имплантата, ограничение по длине диастаза нерва (для венозных кондуитов длина дефекта не должна превышать 3 см).
Meng (2017) оценивал эффективность аутологичного венозного кондуита, поддерживаемого сосудистым стентом, при регенерации повреждения 10 мм малоберцового нерва у кроликов [3]. Регенерацию нервов и функциональное восстановление оценивали с помощью электрофизиологических исследований, сравнения соотношения мышечной массы между левой и правой икроножной мышцей задней конечности, морфологических наблюдений, электронной микроскопии через 12 недель после операции. Группа B (венозный кондуит) имела самый низкий результат для рефлекса торможения, тогда как у группы А (аутологичный трансплантат) был самый высокий результат рефлекса торможения.
2. Тубуляризированные кондуиты из природных и синтетических материалов
Использовались кондуиты с дополнительными направляющими внутри. Waitayawinyu (2007) применил модель повреждения седалищного нерва крысы, дефект 10 мм. В эксперименте было 15 крыс с кондуитом из PGA, 15 крыс с сегментом аутогенного нервного трансплантата, 15 крыс с кондуитами из коллагена [4]. Через 15 недель регенерацию нервов оценивали путем измерения изометрической силы сокращения мышц, подсчета аксонов, веса мышечной массы и гистологии. Коллагеновые кондуиты и аутотрансплантаты дали сопоставимые результаты, которые были значительно лучше, чем регенерация с PGA-кондуитами.
Целью исследования Luis (2007) была проверка in vivo двух различных нервных кондуитов, одного из PLGA, выполненного в новой пропорции (90:10) двух полимеров, Poly (L-лактид): Poly (гликолид), с (DL-лактидом -epsilon-caprolactone) сополиэфира (Neurolac), способствующего регенерации нервов через 10 мм-дефект крысиного седалищного нерва [5]. Молекулярное и сенсорное функциональное восстановление оценивали на протяжении всего периода заживления 20 недель, а с восстановленными нервами проводили морфологический анализ. Как двигательные, так и сенсорные функции были одинаковыми во всех экспериментальных группах восстановления нервов. При сравнении между двумя типами кондуитов не было обнаружено существенных различий.
Canan (2008) подвергал две группы крыс экспериментальной резекции большеберцовых и малоберцовых нервов. Первой группе проводили регенерацию при помощи аутографта. У второй группы регенерация проводилась с коллагеновым кондуитом [6]. Через 90 дней животных умерщвляли, сегменты нерва удаляли и секционировали для микроскопии. Для получения каждого количественного параметра применялись три различные стратегии выборки, то есть размеры малых, средних и больших ступеней. Между этими стратегиями отбора проб нет существенных различий в отношении общего количества миелинизированных нервных волокон, площади поперечного сечения аксонов и толщины миелина.
Okamoto (2009) использовал кондуит из коллагена с направляющими волокнами при повреждении малоберцового нерва размером 30 мм у собак-биглей [7]. Хотя функциональное восстановление происходило в течение 52 недель, морфологический анализ показал, что нужен более длительный период времени для полной регенерации периферического нерва.
Penna (2011) использовал модель повреждения седалищного нерва крысы, 15 мм. Имплантировал кондуит из поливинилхлорида (ПВХ) длиной 19 мм [8]. После имплантации вокруг кондуита из ПВХ, так называемого биогенного кондуита, образовался соединительный слой ткани. Толщина стенки биогенных кондуитов увеличивалась в течение 4-х недель после имплантации. Биогенные кондуиты показали наибольшее количество сосудов на поперечное сечение через 4 недели. Результаты анализа не показали существенной разницы между регенерацией с биогенным кондуитом и аутографтом. Поперечная площадь нерва и количество аксонов в биогенной группе были значительно ниже, чем в группе с аутографтом.
3. Кондуиты с факторами роста и белками внеклеточного матрикса
McKay (2003) на модели повреждения седалищного нерва крысы 10 мм использовал фактор ингибирования лейкемии (LIF), который, действует как «фактор травмы», потенциально увеличивая восстановительный потенциал [9]. LIF повысил эффективность регенерации. Таким образом, экзогенный LIF может сыграть потенциальную роль в развитии подходов к регенерации периферических нервов.
Midha (2003) использовал для регенерации хирургически созданных 10-миллиметровых дефектов на седалищном нерве крысы пористые кондуиты длиной 12 мм с внутренним диаметром 1,3 мм и внешним диаметром 1,8 мм из поли(2-гидроксиэтилметакрилат-со-метилметакрилат) (PHEMA-MMA) [10]. Внутренний просвет кондуитов был заполнен коллагеновой матрицей или матрицей, заполненной либо нейротропином-3, нейротрофическим фактором мозга, либо фактором роста фибробластов. Регенерацию нервов через кондуиты с увеличенным коэффициентом роста оценивали через 8 недель после восстановления гистоморфометрическим анализом. Кондуиты были биостабильны и биосовместимы и поддерживали регенерацию нервов более чем в 90% случаев. Регенерация нервов была лучше с кондуитами, в которые были добавлены факторы роста, по сравнению с пустыми кондуитами и теми, которые содержат только коллагеновый гель (отрицательный контроль). кондуиты, заполненные FGF, продемонстрировали регенерацию, сравнимую с аутотрансплантатами (положительный контроль) и показали значительно лучшую регенерацию, чем другие группы. Время наблюдения – 8 недель.
Lee (2003) разработал новую систему доставки факторов роста, чтобы обеспечить устойчивую доставку фактора роста нервов (NGF) [11]. Эта система доставки использует гепарин для иммобилизации NGF и замедления его диффузии из фибринового каркаса. Ранее эта система улучшала рост нейритов (длинные цилиндрические отростки нервных клеток) in vitro, и в этом исследовании оценена способность этой системы доставки улучшать регенерацию нервов по кондуитам. Протестировано влияние контролируемой доставки NGF на регенерацию периферического нерва при дефекте седалищного нерва с дефектом в 13 мм у крыс. Гепаринсодержащая система доставки изучалась в сочетании с тремя дозами NGF, результаты сравнивались с положительным контролем (изотрансплантаты) и отрицательными контролями (только один фибрин, только NGF и пустые кондуиты). Нервные волокна обрабатывали через 6 недель после операции для гистоморфометрического анализа. Результаты этого исследования показывают, что включение новой системы доставки, обеспечивающей контролируемое высвобождение факторов роста, усиливает регенерацию периферического нерва и представляет собой значительное влияние в усиление регенерации нервных волокон при коротких дефектах.
Mohanna (2003) разработал нервный кондуит из поли-3-гидроксибутирата (PHB), заполненный глиальным фактором роста (GGF), суспендированным в альгинатном гидрогеле [12]. Повреждение в 2-4 см малоберцового нерва кролика. В эксперименте использовали кондуит PHB, содержащий либо GGF в альгинатном гидрогеле (GGF), либо только альгинат, либо пустой кондуит PHB. Ткани анализировали на 21, 42 и 63 день после операции. Регенерацию аксонов и шванновских клеток оценивали с использованием количественной иммуногистохимии. В течение всего времени исследования количество аксонов и шванновских клеток в GGF-трансплантатах было значительно больше, чем в альгинатных и пустых кондуитах, причем последний показал лучшую регенерацию, чем кондуиты с альгинатом. Результаты указывают на ингибирующее действие альгината на регенерацию, что частично отменяется добавлением GGF к каналам. В заключение, GGF стимулирует прогрессирующее и устойчивое увеличение регенерации в длинных нервных каналах.
Ikeguchi (2006) применил модель повреждения седалищного нерва крысы, 15 мм, доказал, что силиконовый кондуит, внутренняя поверхность которого была имплантирована отрицательно заряженными ионами углерода (C-) предварительно обработанная основным фактором роста фибробластов, способствует регенерации периферического нерва, значительно ускоряет регенерацию нервов, и этот эффект усиливается основным фактором роста фибробластов. Анализы проводили на 12 и 24 неделе после операции [13].
De Boer (2011) использовал модель повреждения седалищного нерва крысы длиной 10 мм и оценивал влияние фактора роста нервов (NGF) на кондуит из поли-молочно-ко-гликолевой кислоты (PLGA), соединяющий повреждение седалищного нерва размером 10 мм [14]. Было сравнено 9 групп: PLGA-кондуиты, заполненные физиологическим раствором, физиологическим раствором и NGF с различными концентрациями (5, 20, 50 и 100 мг / мл), ничем не заполненные и с аутологичным трансплантатом, введённые в разрыв седалищного нерва. У аутологичного трансплантата была наибольшая площадь сечения и имела значительно большее количество миелиновых волокон. Не было обнаружено существенных различий в функциональной оценке между группами или между кондуитами с микросферами и кондуитом, заполненным физиологическим раствором. Нервный кондуит PLGA способен поддерживать регенерацию нервов. Система доставки микросфер не препятствует регенерации.
Гистоморфометрия, ретроградное отслеживание, электрофизиология и функциональные результаты оценивались до 16 недели.
Liu (2011) разработал композитный нервный кондуит, состоящий из полимолочной кислоты-капролактона (P(LLA-CL)) и фактора роста нервов (NGF). Использовал модель повреждения седалищного нерва крысы, дефект размером 10мм. Дефекты были соединены мостиком с использованием аутотрансплантата, пустого P(LLA-CL)-кондуита, кондуита с инъекцией NGF в Р(LLA-CL) и композитного кондуита P(LLA-CL)/NGF, соответственно. Регенерированные нервные волокна собирали, а морфологическую и функциональную оценку регенерации нервов проводили через 12 недель после операции. Количество и расположение регенерированных нервных волокон, миелинизация и восстановление нервных функций были одинаковыми в группе кондуитов P (LLA-CL)/NGF и группе нервных аутотрансплантатов, но были значительно больше для пустых кондуитов P (LLA-CL) и с инъекцией NGF в P (LLA-CL). Поэтому композитный P (LLA-CL)/NGF-кондуит, который обладает благоприятными механическими свойствами и биосовместимостью, может эффективно способствовать регенерации седалищного нерва у крыс. Заживление происходило в течение 12 недель.
4. Кондуиты с градиентами нейротрофинов и других факторов роста
Xua (2003) проверил, будет ли устойчивое высвобождение фактора роста нервов (NGF) в нервных направляющих кондуитах увеличивать регенерацию периферического нерва [15]. NGF-содержащие полимерные микросферы (РРЕ) загружали в силиконовые или PPE-каналы, чтобы обеспечить длительную, специфичную для участка доставку NGF. Каналы использовались для соединения 10-миллиметрового дефекта седалищного нерва крысы. Через три месяца после имплантации морфологический анализ выявил более высокие значения диаметра волокна, популяции волокон и плотности волокон по сравнению с пустыми кондуитами. Нервные кондуиты, иммобилизованные с градиентом NGF, имеют потенциал для будущего использования в лечении повреждённых нервов.
Оh (2017) на модели повреждения седалищного нерва крысы (20 мм) изготовил нервный направляющий кондуит (NGC) с фактором роста нервов (NGF) [16]. Скорость нервной проводимости (через 12 и 24 недели) регенерированных нервов через NGC сравнивалась с неповреждённым нервом. Скорости проводимости нервов во всех группах NGC постепенно увеличивались со временем. NGF, иммобилизованный на кондуите усиливал регенерацию нервов. В частности, группа с градиентом NGF показала значительно более высокую скорость проводимости нерва, чем другие группы NGC, что указывает на большую функциональную реннервацию регенерированных нервов через кондуит.
5. Кондуиты с клеточным компонентом в своем составе
Следующим этапом в развитии нервных кондуитов было создание конструкций с использованием клеточного компонента в составе конструкции.
Shimizu (2007) применил два типа конструкций с использованием мезенхимальных стволовых клеток человека, дифференцированных в Шванновские клетки, а также линию Шванновских клеток крысы для восстановления 10-мм дефекта седалищного нерва у крыс [17]. На основе теста walking track было продемонстрировано преимущество ШК по сравнению с МСК. Срок наблюдения — 3 недели. На этой же модели Nie (2007) использовал новый тканевой нерв, заполненный дифференцированными клетками в коллагене, использовал PLGA-кондуит [18]. При этом регенерация нервов оценивалась с помощью измерения седалищного функционального индекса (SFI) ежемесячно и гистологического анализа. Показатель восстановления седалищного нерва был значительно лучше у крыс с аутотрансплантатом и выше, чем у группы с PLGA. У животных, с аутотрансплантатом с дифференцированными EMSCs регенерация была лучше, чем у животных с PGLA-кондуитом. Эти результаты показывают, что когда EMSCs имплантировались в дефект периферического нерва, то они дифференцировались в ШК, которые способствуют продвижению регенерации аксонов. Наблюдения проводили в течение 4 месяцев после операции.
В работе Zhang (2008) модель повреждения седалищных нервов была построена на левых ногах у крыс SD (10 мм) с использованием деацетилхитинового канала [19]. Три группы: группа А — трансплантат нерва in situ (n = 12, расстояние между зазорами 10 мм); группа B — биологический канал хитина, перекрывающий дефект периферического нерва (n=12, расстояние зазора 10 мм) и группа C — биологический канал хитина, соединяющий дефект периферического нерва с нервными волокнами в каналах (n = 12, расстояние зазора 10 мм). Электрохимическое, гистологическое исследование и подсчет повторных миелинизированных аксонов были проведены на 6-й и 12-й недель после операции. Скорость нервной проводимости и подсчет повторных миелинных аксонов группы А были лучше, чем у группы В и С, а в группе С лучше, чем в группе В.
Erba (2010) использовал модель повреждения седалищного нерва у крысы в виде дефекта длиной 10мм. ADSC, трансплантированные в искусственном нервном кондуите (PHB), стимулируют рост аксонов от проксимального нервного конца и вызывают большую пролиферацию Шванновских клеток в дистальный конец [20]. Эти результаты свидетельствуют о том, что любой регенерирующий эффект трансплантированных ADSC, скорее всего, опосредуется начальным повышением высвобождаемых факторов роста и / или косвенным воздействием на эндогенную активность ШК.
Mohammadi (2015) изучил влияние трансплантации некультивированной стромальной сосудистой фракции (СВФ) на регенерацию седалищного нерва. 10-миллиметровый дефект седалищного нерва соединяли с помощью силиконового кондуита, заполненного СВФ [21]. Контрольная группа: силиконовый кондуит заполняли только фосфатно-буферным солевым раствором. Поведенческие и функциональные исследования подтвердили более быстрое восстановление регенерированных аксонов у животных с СВФ, чем в контрольной группе. Мышечная масса у животных в группе СВФ была значительно больше, чем в контрольной группе. Морфометрические индексы регенерированного волокна показали, что количество и диаметр миелиновых волокон значительно выше у животных с СВ, чем в контрольной группе. Трансплантация СВФ в сочетании с силиконовым кондуитом может рассматриваться как легкодоступный источник стромальных клеток, который улучшает функциональное восстановление седалищного нерва. Наблюдения проводили в течение 8 и 12 недель после операции.
Подробнее здесь
Свежие комментарии