Последнее десятилетие , в области изучения микрофлоры человека, открыло во всем многообразии удивительный и густонаселенный мир микроорганизмов. Сегодня ученые считают устаревшим термин «микрофлора», предлагая более широкое понятие под названием «микробиом», или «микробиота». Микрофлора долгожителя формируется при богатом потреблении овощей, бобовых, капусты брокколи и других крестоцветных, круп, зелени, кефира. Следующая статья написана Евгенией Малышевой и незначительно скорректирована мною. Благодарю Женю за любезно предоставленную статью. Блог Евгении Малышевой.
Когда еда и диетическое волокно попадают в кишечник (из овощей или бобовых), в результате метаболизма бактерий активируется Gpr41, который уменьшает кровяное давление на величину от 3,98 до 6.12 мм рт. ст.
То, что в почках находятся обонятельные рецепторы, стало сюрпризом даже для ученой, которая сделала это открытие – Дженнифер Плужник. Принимая во внимание их основной функционал – выделительную и осморегулирующую функцию, трудно было понять для чего нужен белок, необходимость присутствия которого, к примеру, в слизистой носа не вызывает вопросов. Тем не менее, когда она углубилась в изучение функций обонятельных рецепторов, то пришла к выводу: почки получают сообщения от бактерий, которые живут в кишечнике и находятся с нами в симбиозе. Ученые обнаружили механизм влияния микробиоты кишечника на кровяное давление.

НА рисунке SCFA — короткоцепочечные жирные кислоты.
С помощью обонятельных рецепторов почки способны поддерживать прямую молекулярную связь с бактериями и, таким образом, регулировать кровяное давление. Обонятельный рецептор 51E2 (также известный как Olfr78 у мышей, и OR51E2 у человека) был мало исследован, ранее он был найден в сенсорных тканях носа. Но не было определено, на какой конкретный запах и вещество он реагирует. Плужник начала проверять все возможные сочетания химических веществ, и в конечном итоге список возможных кандидатов сузился до ацетата и пропионата. Эти молекулы короткоцепочечных жирных кислот синтезируются в процессе ферментативного распада длинных цепей углеводов — того, что диетологи называют диетическим волокном.
Многие фрукты, овощи и бобовые связаны с увеличением короткоцепочечных жирных кислот (КЖК) в питании за счёт того, что клетчатка из них является пищей для бактерий, синтезирующих КЖК.
Люди, мыши, крысы и другие животные не могут переваривать волокно. Но бактерии, которые живут в их кишках, могут. В результате более 99 процентов ацетата и пропионата, которые попадают в кровоток, являются продуктами метаболизма бактерий. Поэтому бактерии являются единственным значимым источником того, что активирует Olfr78, что, как показали дальнейшие эксперименты, связано с регуляцией артериального давления. Организм может контролировать артериальное давление с помощью гормона — ренина, который сужает кровеносные сосуды, когда необходимо повысить давление. Olfr78, как обнаружили Плужник и ее коллеги, помогает управлять синтезом ренина.
Изучая Olfr78, ученые нашли еще один рецептор, сопряженные с G-белком, под названием Gpr41, который также получает сигналы от микробиома кишечника. Gpr41 был обнаружен на внутренних стенках кровеносных сосудов. Как и Olfr78, Gpr41 также реагирует на ацетат, однако более чувствителен к пропионату, но этот рецептор снижает кровяное давление, а не повышает его. Более того, Gpr41 начинает реагировать на низкие уровни ацетата и пропионата, тогда как Olfr78 срабатывает только при высоких уровнях. Взаимодействие рецепторов и микробиома можно описать следующим образом: когда еда и диетическое волокно попадают в кишечник, в процессе метаболизма бактерий в нем образуются короткоцепочечные жирные кислоты. Это активирует Gpr41, который уменьшает кровяное давление, поскольку короткоцепочечные жирные кислоты попадают в кровоток. Чтобы давление не упало до очень низких значений, когда концентрация короткоцепочечных жирных кислот достигает пика, включается Olfr78, заставляя кровеносные сосуды сжиматься через выработку ренина.
Понимание того, как симбиотические бактерии влияют на кровяное давление, открывает новые горизонты в терапии, заключающейся в модуляции микробиоты.
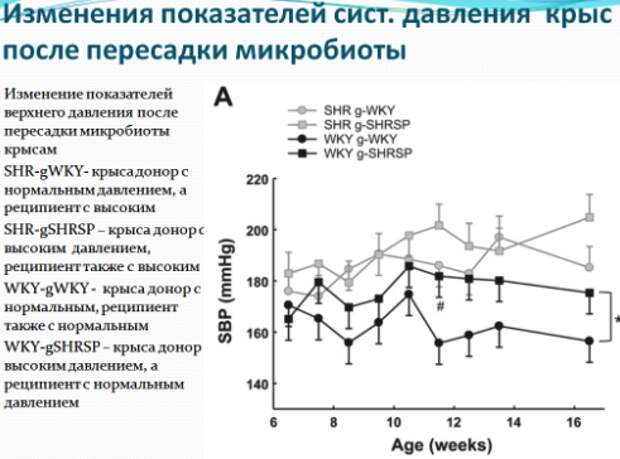
Возможно, фекальные трансплантаты будут одним из рабочих решений. По крайней мере, такие выводы можно сделать из недавнего исследования, где группе крыс с нормальным артериальным давлением пересаживали микробиоту крыс гиперстеников (с повышенным артериальным давлением) и наоборот. У крыс реципиентов с нормотензией, получивших трансплантанты от доноров с высоким давлением, давление было выше, чем у крыс той же группы, которым пересадили микробиоту от крыс с нормальным давлением. Не смотря на то, что давление у крыс реципиентов повысилось, оно было ниже, чем у доноров гиперстеников, что показывает, что дисбиоз кишечника является не единственным механизмом повышения давления. Поэтому пересадка крысам гипертоникам микробиоты здоровых крыс несколько снизила давление у этих крыс, но эффект был статистически незначимым. Однако на то, что микрофлора здоровых крыс не смогла снизить давление, могла также повлиять успешность пересадки микробиоты: многомерное шкалирование показало, что пересадка крысам с нормальным артериальным давлением микробиоты гипертоников (с повышенным артериальным давлением) завершилась успешно – микробиота крыс с нормотензией (с нормальным давлением) стала похожей на микробиоту доноров гипертоников, в то время как пересадка в обратную сторону от здоровых крыс к гипертоникам оказалась менее успешной.

Таким образом, доказано, что состав микробиоты влияет на показатели давления, и требуются дальнейшие исследования по изучению возможностей успешной модуляции микробиоты возможно через прием новых форм пре и пробиотиков. На данный момент терапия с помощью пробиотиков может лишь немного снижать показатели артериального давления. Метаанализ 14 рандомизированных, плацебо-контролируемых клинических испытаний, включающих в общей сложности 702 участников показал скромное, хотя и статистически значимое, снижение систолического (-3мм рт. ст.) и диастолического (-1мм рт. ст.) давления. Эффект был более выраженным у пациентов с гипертонией (-3,98 мм рт. ст систолическое АД), чем у нормотензивных участников (-2,09мм рт.ст.),и был более выражен в шести японских исследованиях(-6,12 мм рт. ст.), чем в восьми европейских.
Отдельный метаанализ оценивал влияние пробиотиков на уровень артериального давления в девяти рандомизированных, контролируемых испытаниях с участием 543 участников. В целом, анализ показал статистически значимое снижение систолического артериального давления (-3,56 мм рт.ст.; 95% ДИ -6,46 до -0,66) и диастолического артериального давления (-2,38 мм рт.ст.; 95% ДИ-3,84 до -0,93), но индивидуальный эффект сильно отличался от исследования к исследованию. Йогурт был основным источником пробиотиков в этих исследованиях (4 из 9), но остальные исследования включали также другие кисломолочные продукты (сыр и капсулы), содержащие специфические бактериальные штаммы.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pmc/articles/PMC5474689
- www.ncbi.nlm.nih.gov/pubmed/28011881
- www.ncbi.nlm.nih.gov/pmc/articles/PMC5243208
Известно, что короткоцепочечные жирные кислоты обладают противовоспалительным эффектом, и диета богатая клетчаткой снижает потерю костной массы у пациентов с ревматоидным артритом. Результаты этих исследований сподвигли ученых на дальнейшее изучение воздействия короткоцепочечных жирных кислот на потерю костной массы после менопаузы или во время воспалительных процессов. Ученые проводили на крысах несколько интервенций: диету обогащали клетчаткой, давали крысам короткоцепочечные жирные кислоты напрямую или модулировали микробиоту. После приема короткоцепочечных жирных кислот и диеты богатой клетчаткой у крыс росло содержание короткоцепочечных жирных кислот в сыворотке крови и костном мозге и снижалась активность остеокластов (клеток, разрушающих костную ткань), а следовательно снижалось разрушение кости. Пропионовая и масляная короткоцепочечные жирные кислоты (пропионат и бутират) вызывали метаболическое перепрограммирование остеокластов, что приводило к усилению гликолиза за счет окислительного фосфорилирования, тем самым снижался уровень специальных белков, таких как TRAF6 и NFATc1, необходимых для дифференцировки остеокластов. В целом, эти данные характеризуют короткоцепочечные жирные кислоты как мощные регуляторы метаболизма остеокластов и костного гомеостаза.
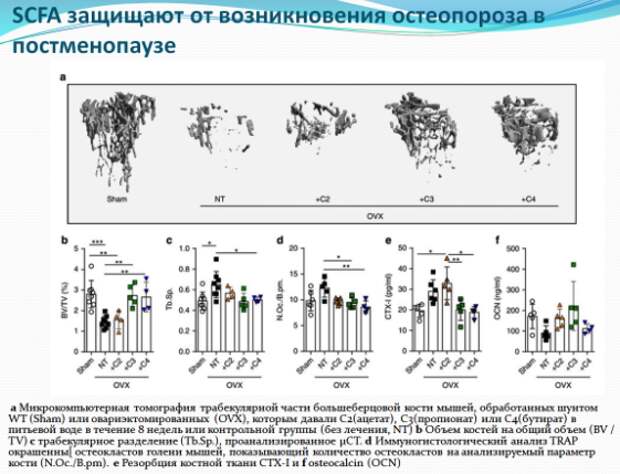
Еще более важно то, что в случае потери костной массы при воспалении, может быть особенно полезной комбинация противовоспалительных иммуномодулирующих свойств короткоцепочечных жирных кислот вместе с прямым ингибированием активности остеокластов. В этом контексте можно объяснить преимущества применения диеты средиземноморского типа, богатой клетчаткой, которая повышает уровень короткоцепочечных жирных кислот, для больных ревматоидным артритом.
Ссылки на исследования:Бутират, который синтезируется микрофлорой при употреблении овощей и бобовых, может снижать риск рака толстой кишки, опухоли мозга, способен влиять на продолжительность жизни животных, изменяя работу генов.
Давайте рассмотрим воздействие короткоцепочечных жирных кислот на увеличение продолжительности жизни. Жизнь продлевала одна из продуцируемых в кишечнике летучих кислот (короткоцепочечная жирная кислота) — масляная кислота или бутират. В серии опытов она увеличивала продолжительность жизни модельных животных: например, у плодовых мух Drosophila melanogaster увеличилась средняя и максимальная продолжительность жизни на 25.8 и 11.5 соответственно. Эффект был дозозависимым, и дозы выше 100 mM даже снижали продолжительность жизни, в то время как оптимальный эффект был достигнут при дозировке (10-40mM). Эффект зависел также от стадии, на которой насекомому начинали давать натриевую соль масляной кислоты (SB): увеличение продолжительности жизни во всех исследованиях было при приеме натриевой соли масляной кислоты на стадии личинки, в то время как прием на стадии взрослого насекомого или прием в течение всех стадий мог дать различный результат, как положительный, так и отрицательный или нулевой. Этот факт может означать, что воздействие натриевой соли масляной кислоты происходит через эпигенетические механизмы продления жизни, базирующиеся на модификации гистонов, и может быть связан с тем, что на разных стадиях жизни насекомого (стареющих животных) паттерны экспрессии генов отличаются. Изменения в ацетилировании гистонов и экспрессия генов белков шаперонов способствовала продлению жизни D. melanogaster. Кроме того натриевая соль масляной кислоты воздействовала и через другие механизмы. Так в исследовании натриевая соль масляной кислоты снижала раннюю смертность мух с, индуцированной пестицидами, болезнью Паркинсона. Натриевой соли масляной кислоты-опосредованно индуцированная выживаемость мух с ротенон-индуцированной болезнью Паркинсона проявлялась повышенными уровнями дофамина в мозге мухи.
Кроме стадии, с которой начинался прием натриевой соли масляной кислоты (SB), на усиление продлевающих жизнь эффектов SB влияло также время жизни насекомого: коротко живущие виды мух были более чувствительны к терапии SB, чем долгоживущие виды. Кроме того гендер насекомого также имел значение для увеличения продолжительности жизни. Sodium Butyrate увеличивал среднюю продолжительность жизни червей C.elegans на 20% и усиливал их термостойкость, также в эксперименте на C.elegans SB увеличивала продолжительность жизни через экспрессию генов SATB-1 и CBP. Экспрессия этих же генов у мышей, доказано, снижается с возрастом и с появлением диабета. Линия мышей с усиленной активностью этих генов жила дольше, чем линия, где активность была снижена. Что касается мышей, то SB увеличивала продолжительность жизни мышей с амиотрофическим склерозом и снижала мускульную атрофию у пожилых мышей.
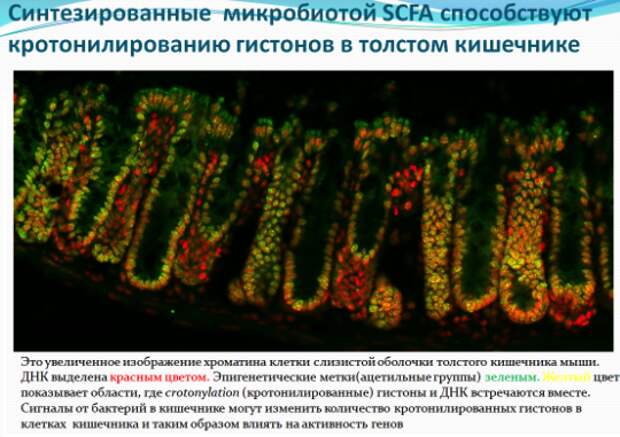
Связь между короткоцепочечной жирной кислотой (бутиратом), как ингибитором HDAC и меньшим риском возникновения рака прямой кишки, недавно открыли ученые. Команда, возглавляемая доктором Патриком Варга-Вайшем (Patrick Varga-Weisz), доказала, что метаболиты, производимые бактериями в кишечнике, могут изменять активность генов в клетках слизистой кишечника. И, в конечном итоге, влияют на поведение этих клеток. Команда ученых показала, что короткоцепочечные жирные кислоты увеличивают количество кротонилированных гистонов, отключая белок под названием HDAC2. Ученые считают, что изменение количества подобных «меченых» гистонов может изменить активность генов путем их включения или выключения. Это новое исследование показало, что бутират увеличивает количество эпигенетических меток в виде остатков кислот на наших генах. Речь идёт о недавно открытом процессе кротонилирования (crotonylation), еще одной формы генетической манипуляции, отличающейся от широко известного метилирования. Оба процесса изменяют экспрессию генов, при этом сам генетический код не изменяется. В то время как процесс метилирования включает в себя добавление метильной группы (СН3) к нуклеотидному основанию — обычно цитозин (С), но иногда аденозин (А) — ацетилирование и кротонилирование связывает ацильную группу (ацетильную или кротонильную) с белками упаковщиками ДНК – гистонами. Гистоны все время взаимодействуют с ДНК, но они могут упаковать ее очень плотно, что ведет к уменьшению промежутка между нуклеосомой и намотанной на неё ДНК, так что с ней нельзя будет работать, а могут, наоборот оставить доступ, менее крепко связываясь с ДНК, так что с нее смогут считывать генетическую информацию специальные молекулярные машины.
Насколько сильно гистоны упакуют ДНК, зависит от того, какие на них будут химические модификации. У каждой клетки есть целый набор ферментов, которые вешают или снимают с гистонов те или иные химические метки, заставляя эти белки упаковывать ДНК то плотнее, то слабее. К таким ферментам относятся и вышеупомянутые гистоновые деацетилазы (HDAC) – они занимаются тем, что снимают с гистонов химические метки в виде остатков кислот. Но и их активность тоже зависит от разных факторов, в том числе и от разнообразных молекул, которые могут эти ферменты выключать. В итоге, с гистонов никто не снимает метки, которые навесили на них другие ферменты. Такие меченые (кротонилированные) гистоны связываются с ДНК иначе, чем «чистые» гистоны, и особым образом настраивают активность генов.
Мышам в эксперименте давали антибиотики, чтобы уничтожить большую часть их микрофлоры. В результате синтез короткоцепочечных жирных кислот снизился, а эпителиальные клетки кишечника мышей содержали большее количество белка HDAC2, чем обычно. В ходе предыдущих исследований учёные выяснили, что увеличение экспрессии HDAC2 в толстой кишке связано с возникновением рака кишечника. Исследователи полагают, что регулирование процесса кротонилирования в геноме кишечных клеток имеет большое значение для предотвращения развития этого вида рака. Кротонилирование активируется посредством ингибирования экспрессии белка HDAC. Ученые также обнаружили высокие уровни кротонилирования гистонов в головном мозге. Поскольку короткоцепочечные жирные кислоты могут преодолевать гематоэнцефалический барьер, вероятно, они могут влиять на модификации гистонов и в мозге, и это также предстоит выяснить ученым.
Ссылки на исследования:
- https://link.springer.com/article/10.1134%2FS2079057013010153
- www.ncbi.nlm.nih.gov/pubmed/23623990
- https://link.springer.com/chapter/10.1007%2F978-3-319-18326-8_11
- www.nature.com/articles/s41467-017-02651-5
Исследователи Бэйлорского медицинского колледжа и университета Техаса под руководством адъюнкт-профессора Мэна Вана (Meng Wang), нашли бактериальные гены и синтезируемые бактериями соединения, способные увеличивать продолжительность жизни и замедлить прогрессию опухолей, а также уменьшать ассоциированного с болезнью Альцгеймера накопление бета-амилоида у нематод Caenorhabditis elegans. По техническим причинам этот вопрос очень сложно изучать на млекопитающих, поэтому исследователи использовали в качестве модели круглых червей C.elegans, представляющих собой прозрачные простые организмы размером с булавочную головку, геном которых во многом схож с геномом человека. В течение 2-3-недельного жизненного цикла эти черви питаются бактериями, вырастают во взрослую особь, размножаются и прогрессивно стареют, утрачивая силу и здоровье, и умирают. Множество лабораторий используют C.elegans в качестве модели для изучения фундаментальных биологических процессов.
До сих пор никто не проводил систематический, полногеномный поиск геномных ассоциаций у бактерий, которые бы оказывали геропротекторное воздействие на C. elegans. Для изучения влияния бактериальных генов по отдельности на продолжительность жизни C.elegans ученые использовали полную библиотеку делеций (удалений) фрагментов генов кишечной палочки Escherichia coli – коллекцию штаммов, каждый из которых является носителем делеции одного из 3983 генов.
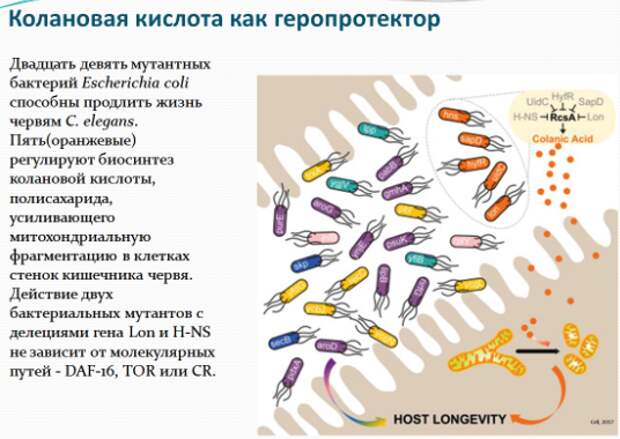
Они скармливали червям бактерии мутантных штаммов и после этого оценивали их продолжительность жизни. В результате оказалось, что для почти 4 000 протестированных бактериальных генов делеции 29 бактерий мутантов продлевали жизнь червям более чем на 10%. Мутант-чемпион, кодирующий транскрипционный регулятор, смог увеличить продолжительность жизни червей на 40%. Многие из мутантов не продлевали жизнь червей, которые уже имели мутации в генах, ранее известных модуляторов продолжительности жизни, таких как daf-16, rsks-1, raga-1, rict-1 или мутацию, которая имитирует ограничение калорийности. Также ученые проверяли влияние бактериальных мутаций на такие возраст-зависимые заболевания, как рак и болезнь Альцгеймера. Исследователи протестировали мутантные бактерии на C. elegans, подверженных развитию опухолей, и в Aβ-экспрессирующих трансгенных червях. Последние были разработаны Крисом Линком в Университете Колорадо в Боулдере; они экспрессируют Aβ42 под контролем мышечно-специфического не-54 промотора / энхансера. Четырнадцать бактериальных мутантов продлевали жизнь этих трансгенных червей на 10-40%. При этом 12 из них отодвигали развивающийся у C.elegans возрастной паралич. Интересно, что 13 из 14 мутантов, продлевающих жизнь, также продлевали жизнь нематод, подверженных развитию опухоли.
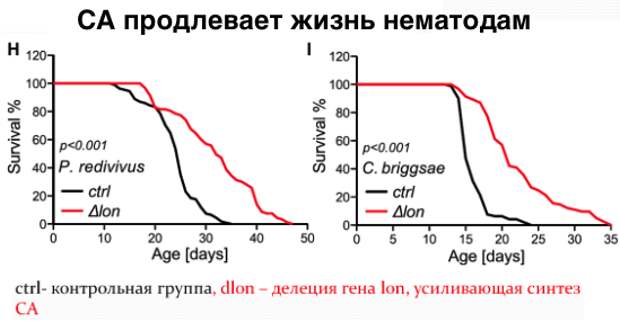
Дальнейшие эксперименты показали, что употребление в пищу определенных мутантных штаммов кишечной палочки увеличивало продолжительность жизни нематод посредством воздействия на ряд неизученных ранее процессов, ассоциированных со старением этих организмов. Эти мутанты способствовали долголетию за счет повышенной продукции колановой кислоты – полисахарида, составляющего защитную капсулу бактерий. Добавление очищенной колановой кислоты в пищу червей также увеличивало продолжительность их жизни, хотя и в меньшей степени, чем при использовании мутантных бактерий. Аналогичное влияние колановая кислота оказывала при добавлении в корм лабораторных плодовых мушек, а также в среду культивирования человеческих клеток.
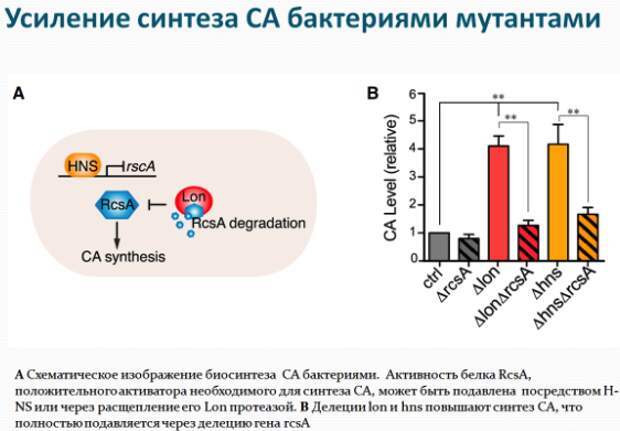
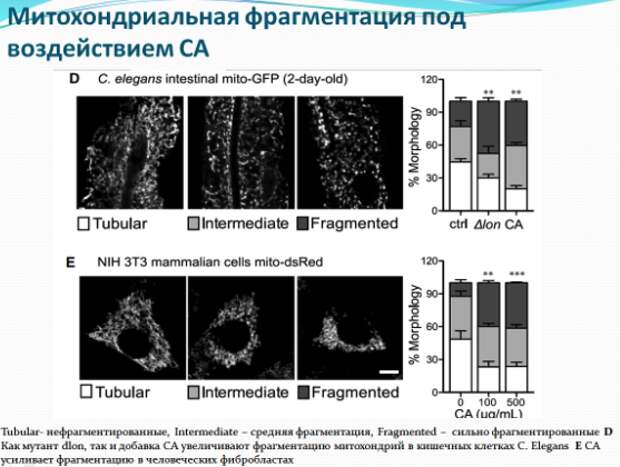
Исследователи провели поиск мутаций, при которых колановая кислота не оказывала бы положительного влияния на червей. Действительно две мутации связанные с повреждением электрон-транспортной цепи митохондрий нивелируют эффекты колановой кислоты. Интересен также установленный ими факт, что колановая кислота регулирует динамику процессов слияния и деления митохондрий – внутриклеточных структур, являющихся энергетическими центрами клетки. Ван и ее коллеги заметили, что митохондрии в кишечных клетках червей, питающихся колановой кислотой, были более фрагментированными, чем у необработанных нематод. Это СА-индуцированное расщепление митохондрий также происходило в клеточной линии фибробластов млекопитающих. Несмотря на то, что митохондриальная фрагментация в стареющих мышцах стенок тела червя считается признаком возрастной атрофии, исследователи полагают, что фрагментация в клетках кишечника и фибробластах, вызванная колановой кислотой, может отражать усиление механизма «контроля качества» здоровых клеток (митофагии), который избавляет клетки от поврежденных или дисфункциональных митохондрий. Как известно белки DRP-1 (диамин-подобный белок 1) необходимы для деления митохондрий и связаны с увеличением продолжительности жизни. Исследователи добавили колановую кислоту к drp-1 мутантным червям, и, как и ожидалось, колановая кислота не смогла увеличить продолжительность жизни.
Исследователи предполагают, что в будущем полученные ими данные лягут в основу разработки препаратов для замедления процессов старения на основе бактерий или их компонентов. Эти наблюдения также могут помочь разобраться во взаимодействиях между микроорганизмами и их хозяевами. Существует гипотеза, согласно которой митохондрии появились в результате эволюции бактерий, миллионы лет назад проникших внутрь примитивных клеток. Полученные авторами данные свидетельствуют о том, что бактерии и по сей день оказывают влияние на взаимодействие митохондрий внутри клеток живых организмов. Судя по всему, этот тип взаимодействия очень важен, и его детальное понимание позволит разобраться в глубинных взаимоотношениях между бактериями и организмами, с которыми они сосуществуют. Перед исследователями стоят еще несколько нерешенных проблем: предстоит выяснить механизм синтеза колановой кислоты in vivo, пока ученым известно, что клеточные культуры синтезируют колановую кислоту в ответ на стресс во время формирования биофильма. Также не решена проблема почти в двое меньшей эффективности чистой колановой кислоты по сравнению с кислотой, синтезированной бактериями мутантами.
Окажет ли эта работа влияние на лечение нейродегенеративных заболеваний? Крис Линк отметил, что взаимодействие митохондрий и колановой кислоты соответствует его неопубликованному наблюдению, что смещение баланса митохондриального деления и слияния в сторону деления делало Aβ-экспрессирующих трансгенных червей более мобильными. У червей с нокаутом гена, кодирующего белок DRP-1, уменьшалось деление митохондрий, что и ожидалось, но также усиливался паралич. Тогда как выключение EAT-3, гена, необходимого для митохондриального слияния, делало червей более активными. Линк добавил, что многие митохондрии в мышечных клетках были деформированы и деполяризованы, и он подозревает, что амилоид может вызывать повреждения в них. Если это так, то увеличение оборота органелл может быть полезным. Неясно только, как этот сценарий развернется в мозге.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pmc/articles/PMC5587646
- www.alzforum.org/news/research-news/longevity-through-gut-ba...
Если воздействие через метаболиты C. Sporonges на здоровье организма пока только в планах ученых, то применение коктейля из генномодифицированных бактерий Escherichia coli(грамотрицательные бактерии, входящих в состав нормальной микрофлоры желудочно-кишечного тракта человека) и сульфорафана уже прошло удачное тестирование на модельных животных. Сульфорафан из капусты брокколи – это вещество широко известное своими антиканцерогенными свойствами, однако проблемой химиопрофилактики с помощью сульфорафана была его низкая биодоступность. Сульфорафан синтезируется в крестоцветных из содержащихся в них глюкозинолатов под воздействием фермента мирозиназы, когда клетки растений разрушаются (например, при жевании капусты брокколи). Однако мирозиназа чувствительна к температуре и в кулинарно обработанных овощах остается лишь небольшое количество этого фермента, а мирозиназы, синтезируемой человеческой микрофлорой, недостаточно для проявления антираковых свойств сульфорафана. Низкая доза этого противоопухолевого соединения может быть неэффективной в отношении раковых клеток, а высокая вызвать цитотоксичность.
(...)
Подробнее здесь
Свежие комментарии